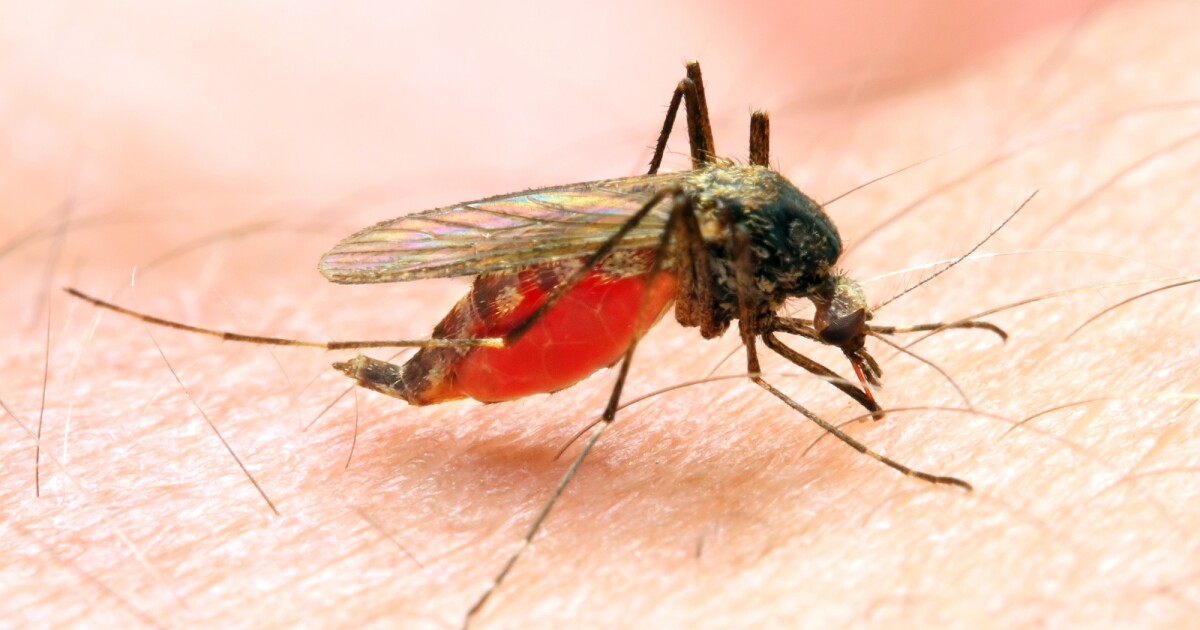
Los investigadores se han topado con una bacteria presente naturalmente en el intestino de los mosquitos que inhibe el crecimiento de un parásito que causa la forma más mortal de malaria. Aunque es poco probable que produzca resistencia, la bacteria podría introducirse fácilmente en el campo para complementar las estrategias existentes de erradicación de la malaria.
La malaria, una enfermedad transmitida por mosquitos, es causada por cinco parásitos protozoarios, con Plasmodium falciparum siendo el más mortífero entre ellos y el más frecuente en el continente africano. A diferencia de sus parientes protozoarios, P. falciparum Infecta todo tipo de glóbulos rojos, desde células jóvenes inmaduras hasta células viejas. Si no se trata, P. falciparum la malaria puede progresar a una enfermedad grave y la muerte en 24 horas.
El impacto de la malaria es bien reconocido, pero se han logrado pocos avances en la reducción de las muertes por esta enfermedad. Según las últimas informe Según la Organización Mundial de la Salud (OMS), hubo 249 millones de casos de malaria en 2022, frente a 244 millones en 2021. Ahora, los investigadores se han topado con una bacteria que previene la P. falciparum que el parásito se desarrolle en el mosquito hembra que transmite la malaria.
Mientras estudiaban una colonia de mosquitos como parte de la investigación para el desarrollo de nuevos medicamentos para GlaxoSmithKline (GSK), los investigadores notaron que cada vez era más difícil infectarlos. P. falciparum. Al observar más de cerca a los mosquitos y sus entornos de reproducción, descubrieron que los insectos portaban una cepa bacteriana simbiótica llamada Delftia tsuruhatensis TC1, que ralentizó el crecimiento de los protozoos en el intestino del mosquito, donde normalmente se desarrolla antes de pasar a las glándulas salivales.
Para investigar el potencial de bloquear la transmisión de los parásitos de la malaria en otros mosquitos, los investigadores realizaron experimentos de laboratorio, dando D. tsuruhatensis TC1 a mosquitos hembra seguido de un Plasmodio-harina de sangre infectada. Generalmente se observa en el intestino en pequeñas cantidades, el número de D. tsuruhatensis TC1 aumentó aproximadamente 100 veces después de la ingesta de sangre y se observó en todos los mosquitos. Una vez ingerido, P. falciparum inhibió el 73% de la formación de oocistos, deteniendo el desarrollo durante al menos 16 días después de la colonización y posiblemente durante toda la vida del mosquito. Sólo el 33% de los ratones se infectaron cuando fueron picados por mosquitos portadores de la bacteria.
La presencia de D. tsuruhatensis TC1 no afectó la longevidad del insecto y aun así produjeron la misma cantidad de huevos. Tampoco afectó significativamente su tasa de alimentación de sangre. Las bacterias no fueron liberadas en el comedero cuando D. tsuruhatensis Los mosquitos infectados con TC1 se alimentaban de sangre, lo que sugiere que D. tsuruhatensis TC1 no se puede transmitir a los humanos mediante una mordedura.
El análisis molecular mostró que los efectos de la bacteria se debían a la producción de una molécula activa llamada harmane, que, según descubrieron los investigadores, puede absorberse a través de la superficie externa del insecto (cutícula) y mediante la digestión.
Los estudios de campo llevados a cabo en Burkina Faso, África occidental, demostraron que los mosquitos que adquirieron la bacteria en el campo fueron colonizados tan eficientemente (o más) por D. tsuruhatensis TC1 como mosquitos criados en laboratorio. Los estudios de campo, combinados con modelos matemáticos, muestran que D. tsuruhatensis TC1 tiene el potencial de usarse junto con estrategias existentes para mejorar los esfuerzos de erradicación de la malaria.
Además, debido a que la bacteria no está modificada genéticamente y es parte de la microbiota normal de los mosquitos, es poco probable que los insectos desarrollen resistencia a ella.
«La identificación de una bacteria que previene el desarrollo de las etapas del parásito que ocurren en los mosquitos sin afectarlos proporciona un enfoque novedoso con muy pocas posibilidades de desarrollar resistencia ya que no es perjudicial para los mosquitos», dijo Alfonso Mendoza-Losana, uno de los coautores del estudio. “Además, se trata de una bacteria no modificada genéticamente, lo que permite una rápida introducción en el campo”.
El estudio fue publicado en la revista Ciencia.
Fuente: UC3M