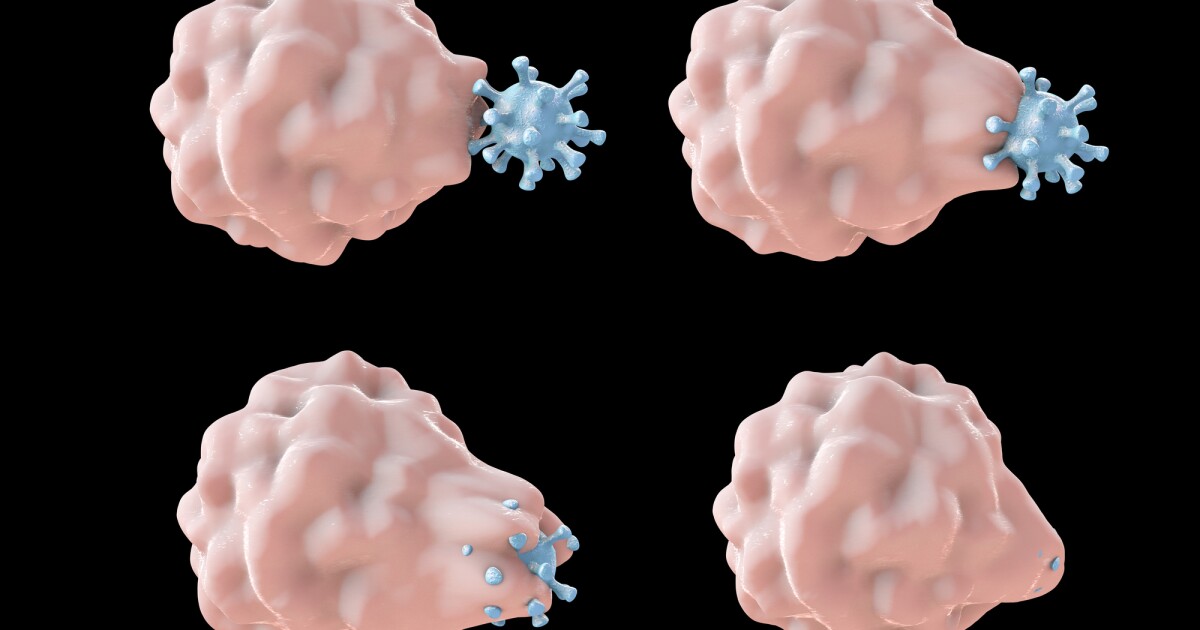
Siguiendo un rastro de evidencia que comenzó con un estudio de moscas de la fruta hace casi 25 años, los investigadores descubrieron que agregar una forma hiperactiva de la proteína Rac2 a los macrófagos, células inmunes que se alimentan de patógenos, hace que canibalicen las células T. La nueva técnica podría potencialmente aumentar la eficacia de un tratamiento contra el cáncer emergente.
Las proteínas rac existen desde hace mucho tiempo. Profundamente conservadas en la evolución, se cree que las proteínas estuvieron presentes en las primeras células nucleadas. Pero, a pesar de su edad, los científicos todavía están descubriendo sus misterios. En un nuevo estudio, investigadores de la Universidad de California en Santa Bárbara (UCSB) descubrieron más sobre cómo funcionan las proteínas Rac y cómo podrían mejorar potencialmente el tratamiento del cáncer.
El genoma humano codifica tres proteínas Rac. Rac1 se expresa de forma ubicua, Rac2 se expresa predominantemente en células que producen componentes sanguíneos (células hematopoyéticas) y Rac3 se expresa principalmente en tejido cerebral. De nuevo en 1996los investigadores que estudiaban las moscas de la fruta descubrieron que las proteínas desempeñaban un papel decisivo en el movimiento celular y que una forma hiperactiva de Rac1, expresada en sólo unas pocas células en la cámara de huevos de una mosca, destruía todo el tejido.
«La simple expresión de este Rac activo en seis a ocho células mata todo el tejido, que está compuesto por unas 900 células», dijo Abhinava Mishra, autor principal del estudio actual.
Eso fue todo lo que llegaron los investigadores en los años 90. No fue hasta hace unos años que comenzaron a surgir investigaciones que sugerían que el canibalismo podría ser la causa de esta destrucción de tejido.
En 2019un estudio publicado en la revista Sangre informaron sobre tres personas no relacionadas con infecciones recurrentes y una falta significativa de células T, glóbulos blancos especializados cruciales para el sistema inmunológico, que tenían la misma mutación que hiperactiva Rac2. El estudio también observó que muchos de los neutrófilos del paciente, células que capturan e ingieren microorganismos invasores, estaban agrandados, lo que indica que estaban consumiendo una gran cantidad de material celular.
Después de leer este estudio, Denise Montell, que participó en la investigación de 1996 y es la autora correspondiente del estudio actual, se preguntó si la desaparición de las células T se debía a que las células inmunes innatas con Rac2 activo se las comían, como había sucedido con la fruta. moscas. Entonces, Montell y los otros investigadores centraron su atención en los macrófagos, la contraparte voraz del neutrófilo. Los investigadores cultivaron macrófagos humanos con y sin Rac2 hiperactivo, junto con células T, y descubrieron que los macrófagos con Rac hiperactivo consumían más células, lo que confirma su hipótesis.
Luego, utilizando muestras de médula ósea de ratones con la misma mutación hiperactiva de Rac2 observada en los pacientes del estudio de 2019, los investigadores cultivaron células madre de médula ósea en macrófagos. Se realizó un experimento similar, pero esta vez mezclando macrófagos y células T con y sin la mutación Rac2. Descubrieron que los macrófagos con Rac activo no solo consumían significativamente más células T, sino que las células T con Rac2 activo también eran más vulnerables al consumo, tuvieran la mutación o no.
Luego cultivaron macrófagos de la médula ósea de ratones normales y mutantes con Rac2 activado. En cada grupo, se hizo que los macrófagos expresaran un receptor ficticio o el receptor de antígeno quimérico (CAR), que están diseñados para atacar las células B, otro tipo de célula inmune. Descubrieron que los macrófagos con receptores ficticios no comían muchas células B; sin embargo, los macrófagos con Rac y CAR hiperactivos comieron el doble de células B que el grupo que solo tenía CAR. La activación de Rac2 también pareció aumentar el número de los llamados «supercomedores», macrófagos voraces que comen y matan múltiples células cancerosas.
«Si agrega Rac activo sin el receptor correcto, no hace nada», dijo Montell.
CAR-T es una inmunoterapia contra el cáncer actual que utiliza las propias células T del paciente y las diseña, agregando el CAR para ayudar a las células a unirse a un antígeno de célula cancerosa específico, al que las células se dirigen y atacan. La terapia es muy eficaz contra algunos cánceres, como la leucemia y los linfomas, pero hay cánceres de tumores sólidos que no responden a ella. CAR-M, un pariente más nuevo de CAR-T que depende de macrófagos en lugar de células T, se ha utilizado recientemente en ensayos clínicos y, hasta ahora, se ha considerado seguro. Sin embargo, una limitación de CAR-M es que los macrófagos CAR tienden a «mordisquear» las células en lugar de engullirlas y comérselas. Por lo tanto, mejorar el consumo de células diana completas es un objetivo importante.
Los investigadores están interesados en aprovechar los macrófagos CAR mejorados con Rac, a los que denominaron ‘RaceCAR-M’ en una patente provisional, para aumentar la eficacia de los tratamientos CAR-M.
También planean continuar su investigación para investigar si su novedosa técnica, que demostró ser efectiva en el laboratorio, se traducirá en células inmunes humanas recién recolectadas y modelos de cáncer animal. Y están explorando cómo actúa Rac2 a nivel molecular para ejercer sus efectos.
«Tuvimos este caso sin resolver de 25 años de antigüedad sobre moscas de la fruta y lo resolvimos», dijo Montell. “Y eso nos ayudó a resolver el misterio de una inmunodeficiencia humana inexplicable. Y luego aprovechamos ese conocimiento para mejorar una posible inmunoterapia contra el cáncer. Era sólo un misterio tras otro, y Rac resultó ser la respuesta a cada uno de ellos”.
El estudio fue publicado en la revista PNAS.
Fuente: UCSB a través de Eurek¡Alerta!